Hallan un factor genético de protección frente la aspergilosis invasiva
Un único polimorfismo en un gen clave en la regulación de los fagosomas determina la susceptibilidad a la invasión pulmonar.
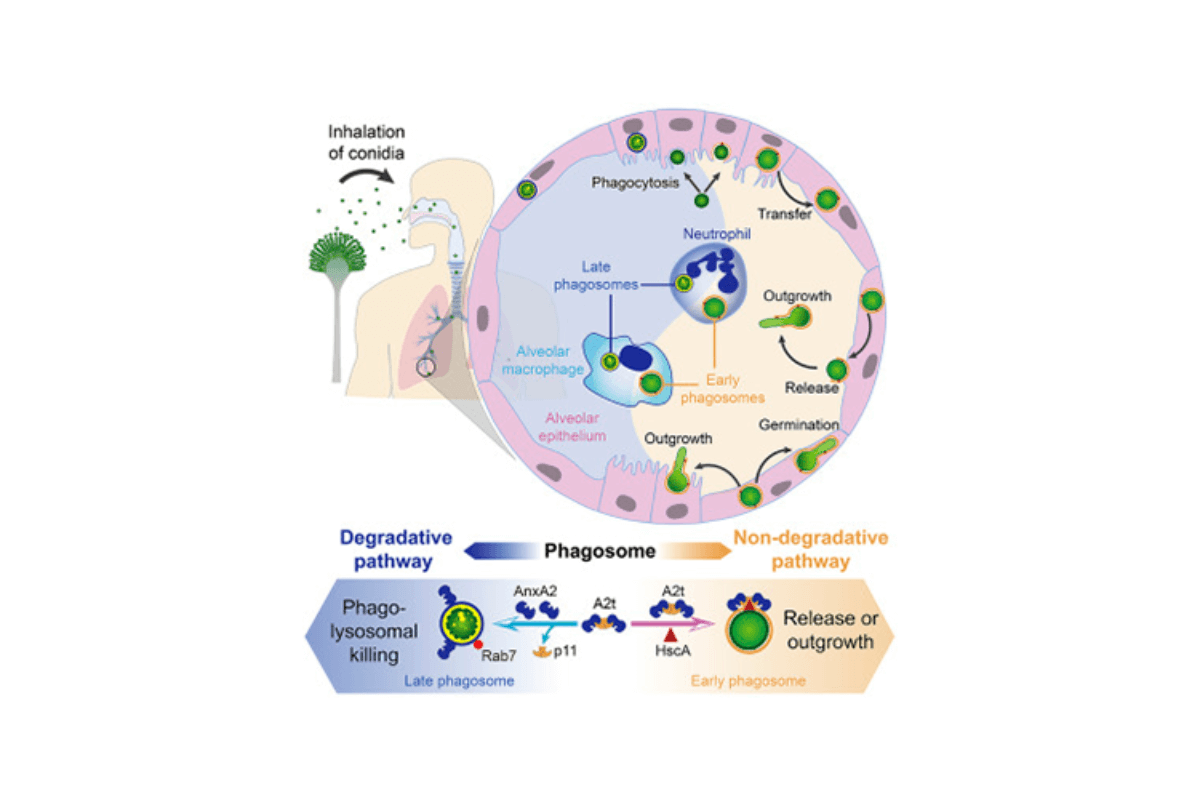
Científicos de diversos centros europeos han dilucidado el mecanismo por el que el patógeno respiratorio Aspergillus (A.) fumigatus se propaga en el epitelio pulmonar. Según los datos obtenidos en un modelo in vitro, la proteína fúngica HscA interacciona con la proteína p11 humana, la cual es inducida por el hongo ...
Científicos de diversos centros europeos han dilucidado el mecanismo por el que el patógeno respiratorio Aspergillus (A.) fumigatus se propaga en el epitelio pulmonar. Según los datos obtenidos en un modelo in vitro, la proteína fúngica HscA interacciona con la proteína p11 humana, la cual es inducida por el hongo y es esencial en el direccionamiento de los fagosomas hacia la exocitosis o a la degradación. Aunque esta última vía es la única que posibilita la eliminación del patógeno, la interacción entre HscA y p11 en fagosomas que contienen conidios favorece la exocitosis, lo que resulta en la transferencia de los conidios a otras células y a la subsiguiente diseminación de la infección. La relevancia clínica de este mecanismo ha sido puesta de manifiesto con el descubrimiento de un polimorfismo genético en p11 que previene su interacción con HscA, protegiendo de la propagación del hongo. Así se demostró en pacientes receptores de médula ósea, en los que la presencia de este polimorfismo se asoció a una reducción del riesgo de aspergilosis pulmonar invasiva.
Axel Brakhage, científico de la Universidad Friedrich Schiller y director del estudio, afirma que el polimorfismo protector está situado en una región no codificadora de p11, la cual modifica la expresión de este gen tanto a nivel de ARN como de proteína, en respuesta a A. fumigatus. Experimentos adicionales demostraron que el redireccionamiento patológico de los fagosomas tiene también lugar en ciertas células inmunitarias del pulmón. Este nuevo polimorfismo puede ser útil en la estratificación de riesgo e identificación de pacientes que pueden beneficiarse de un tratamiento antifúngico profiláctico, concluye Brakhage.
























