Expertos desgranan las oportunidades para ampliar el uso de biosimilares en España
España se encuentra, actualmente, en una posición intermedia en relación a la cuota de mercado de consumo de medicamentos biosimilares, por lo que existe aún margen de mejora, según se desprende del primer estudio realizado sobre este sector, promovido por BioSim, en el que se desgranan las oportunidades existentes para ampliar su uso.

La entrada de los medicamentos biosimilares al mercado español, tras la pérdida de patente de los medicamentos biológicos de referencia, se suma a las prestaciones farmacéuticas existentes en el sistema sanitario. En la actualidad, se encuentran aprobados en la Unión Europea un total de 76 biosimilares de 20 principios activos, ...
La entrada de los medicamentos biosimilares al mercado español, tras la pérdida de patente de los medicamentos biológicos de referencia, se suma a las prestaciones farmacéuticas existentes en el sistema sanitario. En la actualidad, se encuentran aprobados en la Unión Europea un total de 76 biosimilares de 20 principios activos, mientras que en España están aprobados y comercializados 57 medicamentos biosimilares de 17 principios activos.
Para conocer la evolución de este sector en nuestro país, la Asociación Española de Medicamentos Biosimilares (BioSim) ha presentado este martes el primer estudio sobre el mercado de medicamentos biosimilares en el sistema sanitario, en colaboración con la Escuela Andaluza de Salud Pública (EASP), que aporta un análisis pormenorizado del consumo de los medicamentos biosimilares por principio activo y por CC. AA. entre los años 2016 a 2022.
 En la sesión intervinieron desde la directora general y subdirectora de BioSim, Encarna Cruz e Isabel del Río, respectivamente, hasta el director general de Cartera Común de Servicios del SNS y Farmacia, César Hernández, junto con otros expertos como Félix Lobo, presidente del Comité Asesor para la Prestación Farmacéutica y profesor emérito de la Universidad Carlos III, y José María Casado, director de la División de Evaluación del Gasto Público de la Autoridad Independiente de Responsabilidad Fiscal (AIReF), además de Candela Calle, vocal de la Sociedad Española de Directivos de la Salud (SEDISA) y directora general de la Fundación San Francisco de Asís.
En la sesión intervinieron desde la directora general y subdirectora de BioSim, Encarna Cruz e Isabel del Río, respectivamente, hasta el director general de Cartera Común de Servicios del SNS y Farmacia, César Hernández, junto con otros expertos como Félix Lobo, presidente del Comité Asesor para la Prestación Farmacéutica y profesor emérito de la Universidad Carlos III, y José María Casado, director de la División de Evaluación del Gasto Público de la Autoridad Independiente de Responsabilidad Fiscal (AIReF), además de Candela Calle, vocal de la Sociedad Española de Directivos de la Salud (SEDISA) y directora general de la Fundación San Francisco de Asís.
Los análisis realizados muestran algunos aspectos clave que pueden ayudar a configurar las políticas farmacéuticas nacionales y regionales de los medicamentos biosimilares en España en los próximos años. El encargado de presentar los puntos clave del estudio, fue el coordinador del mismo, Jaime Espín, profesor de la Escuela Andaluza de Salud Pública (EASP) quien informó de que es "el primer informe que se hace con datos concretos del consumo de biosimilares en España, aunque por un tema técnico no se han podido disponer de los de la Comunidad Autónoma de Galicia, aunque se ha hecho una extrapolación. Sin embargo, puede ayudar a diseñar las futuras políticas de medicamentos biosimilares".
Se parte de que los principios activos que cuentan con medicamentos biosimilares han visto incrementado su consumo de forma muy significativa desde el año 2016, pasando de 5.275.019 envases en el año 2016 a 11.405.971 envases en 2022 (incremento del 116,2%). Asimimso, se observa una creciente penetración de los medicamentos biosimilares,que han pasado del 17% (922.954 envases) (en el año 2016) al 46% (5.228.080 envases) en el año 2022, según los datos recogidos en dicho informe.
Como subrayó, al respecto, el prof. Espín "España tiene alto margen de mejora en la incorporación de medicamentos biosimilares en el mercado y en su consumo. Actualmente, se encuentra en la mitad del camino", citando algunos países de nuestro entorno referentes como los nórdicos y también Italia y Portugal.
Desde su punto de vista, el diseño de políticas de biosimilares no debe ser de ámbito general sino por sectores, dado que en el hospitalario "donde tiene una penetración bastante aceptable, con un 75%, con una línea ascendente muy interesante, mientras que en el ámbito de la Atención Primaria y oficinas de farmacia, donde la penetración está en torno a un 30%, con datos de 2022, con un alto margen de mejora". De ello se desprende que el mercado de los medicamentos biosimilares de dispensación hospitalaria es más competitivo que el de dispensación en A.P o en oficina de farmacia.
Asimismo, según se señala en el informe, se observa una falta de relación entre el gasto farmacéutico y la penetración de los biosimilares por CC. AA., muy determinado por el escaso peso de los medicamentos biosimilares en el gasto farmacéutico total y ell tipo de patología en función de si es crónica o aguda también puede determinar la tasa de penetración de medicamentos biosimilares.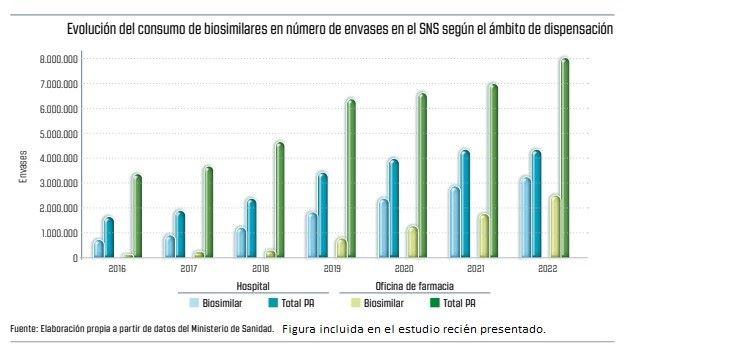
Hacia la creación de un observatorio de biosimilares
En el mismo acto, se celebró un debate sobre la conveniencia de crear un observatorio nacional de biosimilares siguiendo los ejemplos de otros países como Italia o Portugal, con el objetivo de poder disponer de datos de forma periódica y que estén públicamente accesibles para poder hacer estudios de calidad que puedan ayudar a diseñar políticas futuras que mejoren el acceso a los medicamentos biosimilares.
Moderado por Candela Calle, vocal de la Sociedad Española de Directivos de la Salud (SEDISA) y directora general de la Fundación San Francisco de Asís, quien destacó la importancia de dar a conocer el uso del medicamento biosimilar en España, además hacer hincapié en "la necesidad de monitorizar y de aportar más transparencia con respecto a los datos para poder disponer de un buen diagnóstico de situación y de propuestas claras".
Por su parte, el director general de Cartera Común de Servicios del SNS y Farmacia, César Hernández, en su intervención, destacó "la voluntad del Ministerio de Sanidad es ser la fuente primaria de datos y que pudieran estar a disposición del público en tiempo real". Desde su punto de vista, uno de los problemas parte "de una política de precios que no fomenta la competencia", al tiempo que subrayó "que hay que introducir mejoras en las políticas de compra activa y estar preparados para que el momento que haya un lanzamiento de biosimilares poder disponer de dichas políticas". Hernández insistió en "la necesidad de una política de datos abierta, de precios de referencia y de compra, como base para avanzar, dentro de nuestra realidad hacia mayores cuotas de mercado en cuanto a medicamentos biosimilares".
Precisamente, Félix Lobo, presidente del Comité Asesor para la Prestación Farmacéutica y profesor emérito de la Universidad Carlos III, consideró que "el Ministerio de Sanidad tiene una labor de coordinación en cuanto a la disponibilidad de los datos, en su accesibilidad y en hacer que sean fácilmente manejables". Con respecto al Observatorio planteado, a su juicio, "tiene que tener la función propia de los observatorios que radica en situar el foco en un conjunto de problemas que nos preocupan y que tenemos que resolver". Vió con buenos ojos "poner el foco en los biosimilares más de lo que lo estamos haciendo y, en este sentido, el Observatorio puede ser un instrumento pero siempre con el respaldo de la mejora en los datos en sanidad y del medicamento".
Mientras, José María Casado, director de la División de Evaluación del Gasto Público de la Autoridad Independiente de Responsabilidad Fiscal (AIReF), defendió "la granularidad y disponibilidad de los datos que permita hacer un análisis más profundo de la eficacia de las políticas sanitarias y mayor conexión entre las bases de datos". En relación a la creación de un Observatorio como el planteado, consideró necesario "diferenciar capas de información".
Isabel del Río, subdirectora de BioSim, destacó la importancia de poder conocer en base a datos oficiales y a datos completos la evolución del mercado de biosimilares, "a lo que contribuyen informes como el presentado este martes", según destacó, y abogó por "la actualización de este tipo de documentos que permitan monitorizar el mercado y en los que no sólo se incluyan datos de consumo, sino también de políticas".
Para concluir, la directora general de BioSim, Encarna Cruz, explicó que "se ha trabajado con el Ministerio de Sanidad, con CC.AA. y con la Escuela Andaluza de Salud Pública sobre las características que debería contemplar el Observatorio de Medicamentos Biosimiliares en España propuesto", y junto con las ideas recogidas en este debate y junto con el informe de la EASP y BioSim "se podrán dar pasos adelante".























